Spektrofotometri merupakan salah satu metode dalam kimia analisis yang digunakan untuk menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif yang didasarkan pada interaksi antara materi dengan cahaya. Peralatan yang digunakan dalam spektrofotometri disebut spektrofotometer. Cahaya yang dimaksud dapat berupa cahaya visibel, UV dan inframerah, sedangkan materi dapat berupa atom dan molekul namun yang lebih berperan adalah elektron valensi.
Spektrofotometri merupakan salah satu metode dalam kimia analisis yang digunakan untuk menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif yang didasarkan pada interaksi antara materi dengan cahaya. Peralatan yang digunakan dalam spektrofotometri disebut spektrofotometer. Cahaya yang dimaksud dapat berupa cahaya visibel, UV dan inframerah, sedangkan materi dapat berupa atom dan molekul namun yang lebih berperan adalah elektron valensi.
Sinar atau cahaya yang berasal dari sumber tertentu disebut juga sebagai radiasi elektromagnetik. Radiasi elektromagnetik yang dijumpai dalam kehidupan sehari-hari adalah cahaya matahari.
Dalam interaksi materi dengan cahaya atau radiasi elektromagnetik, radiasi elektromagnetik kemungkinanan dihamburkan, diabsorbsi atau dihamburkan sehingga dikenal adanya spektroskopi hamburan, spektroskopi absorbsi ataupun spektroskopi emisi.
Pengertian spektroskopi dan spektrofotometri pada dasarnya sama yaitu di dasarkan pada interaksi antara materi dengan radiasi elektromagnetik. Namun pengertian spektrofotometri lebih spesifik atau pengertiannya lebih sempit karena ditunjukan pada interaksi antara materi dengan cahaya (baik yang dilihat maupun tidak terlihat). Sedangkan pengertian spektroskopi lebih luas misalnya cahaya maupun medan magnet termasuk gelombang elektromagnetik.
Radiasi elektromagnetik memiliki sifat ganda yang disebut sebagai sifat dualistik cahaya yaitu:
1) Sebagai gelombang
2) Sebagai partikel-partikel energi yang disebut foton.
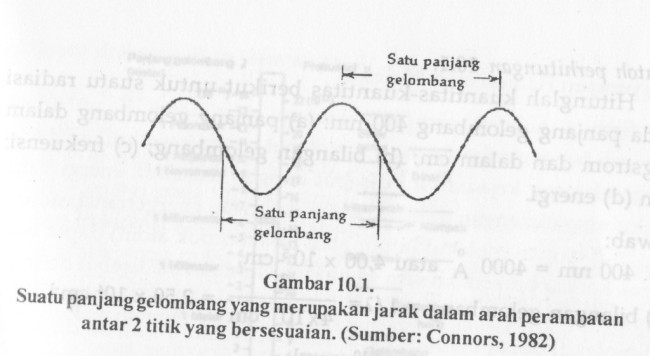
Karena sifat tersebut maka beberapa parameter perlu diketahui misalnya panjang gelombang, frekuensi dan energi tiap foton. Panjang gelombang (l) didefinisikan sebagai jarak antara dua puncak.
ciri suatu senyawa dapat diukur dengan sinar tampak adalah memiliki warna sedangkan senyawa yang diukur dengan ultraviolet adalah tidak berwarna atau bening (karena bentuknya larutan).
Fungsi masing-masing bagian:
1. Sumber sinar polikromatis berfungsi sebagai sumber sinar polikromatis dengan berbagai macam rentang panjang gelombang. Untuk sepktrofotometer
-
UV menggunakan lampu deuterium atau disebut juga heavi hidrogen
-
VIS menggunakan lampu tungsten yang sering disebut lampu wolfram
-
UV-VIS menggunan photodiode yang telah dilengkapi monokromator.
-
Infra merah, lampu pada panjang gelombang IR.
2. Monokromator berfungsi sebagai penyeleksi panjang gelombang yaitu mengubah cahaya yang berasal dari sumber sinar polikromatis menjadi cahaya monaokromatis. Jenis monokromator yang saat ini banyak digunakan adalan gratting atau lensa prisma dan filter optik.
3. Sel sampel berfungsi sebagai tempat meletakan sampel
4. Detektor berfungsi menangkap cahaya yang diteruskan dari sampel dan mengubahnya menjadi arus listrik. Syarat-syarat sebuah detektor :
-
Kepekaan yang tinggi
-
Perbandingan isyarat atau signal dengan bising tinggi
-
Respon konstan pada berbagai panjang gelombang.
-
Waktu respon cepat dan signal minimum tanpa radiasi.
-
Signal listrik yang dihasilkan harus sebanding dengan tenaga radiasi.5. Read out merupakan suatu sistem baca yang menangkap besarnya isyarat listrik yang berasal dari detektor.